25
2023
--
08
หลักการบำบัดเซลล์ผ่านผิวหนัง - TCR-T
เมื่อเร็วๆ นี้ Cell Reports Medicine วารสารนานาชาติชื่อดังได้เผยแพร่ผลวิจัยทางคลินิกเฟส I ของ TAEST16001 ซึ่งเป็นผลิตภัณฑ์บำบัดด้วย TCR-T ตัวแรกของจีน [1] TAEST16001 ใช้สำหรับรักษาเนื้อเยื่ออ่อนมะเร็งชนิดร้ายแรง ซึ่งนับเป็นก้าวสำคัญสู่การแปลทางคลินิกของ ACT ในด้านเนื้องอกแข็ง และจุดประกายความเชื่อมั่นของผู้คนในการรักษาเนื้องอกแข็งด้วยการบำบัดด้วย TCR-T อีกครั้ง ในฉบับนี้ เรามาพูดคุยเกี่ยวกับรายละเอียดของการบำบัดด้วย TCR-T กัน

01 Preface
เมื่อเร็วๆ นี้ Cell Reports Medicine วารสารที่มีชื่อเสียงระดับนานาชาติได้เผยแพร่ผลการวิจัยทางคลินิกเฟส I ของ TAEST16001 ซึ่งเป็นผลิตภัณฑ์บำบัด TCR-T ตัวแรกในประเทศจีน [1] TAEST16001 ใช้สำหรับรักษาเนื้องอกเนื้อเยื่ออ่อนระยะลุกลาม ซึ่งเป็นขั้นตอนสำคัญสู่การแปลทางคลินิกของ ACT ในด้านเนื้องอกเนื้อแข็ง และจุดประกายความเชื่อมั่นของผู้คนใน การรักษาเนื้องอกเนื้อแข็งด้วยการบำบัด TCR-T อีกครั้ง ความเชื่อมั่นในการบำบัดด้วย TCR-T สำหรับเนื้องอกเนื้อแข็ง ในฉบับนี้ มาพูดคุยเกี่ยวกับรายละเอียดของการบำบัดด้วย TCR-T กัน
สภาพแวดล้อมของเนื้องอก (TME) ของเนื้องอกเนื้อแข็งนั้นอุดมไปด้วยสโตรมาขนาดเล็กและเซลล์ที่กดภูมิคุ้มกัน ซึ่งสามารถปกป้องเนื้อเยื่อเนื้องอกจากการโจมตีของเซลล์ภูมิคุ้มกันได้ ตัวอย่างเช่น ในสภาพแวดล้อมขนาดเล็กของมะเร็งตับอ่อน ระดับกรดไฮยาลูโรนิก (HA) ที่เพิ่มขึ้นจะขัดขวางการแทรกซึมของเซลล์ภูมิคุ้มกัน ตัวรับจุดตรวจสอบภูมิคุ้มกันบนเซลล์เนื้องอกหรือเซลล์ที่กดภูมิคุ้มกันสามารถยับยั้งเซลล์ T โดยการจับกับลิแกนด์ควบคุมเชิงลบบนเซลล์ T และในสภาพแวดล้อมของเนื้องอกนี้ ซึ่งขาดกรดอะมิโนที่จำเป็นและออกซิเจนต่ำ เซลล์ T จะแก่ก่อนวัยและลดลง ดังนั้นจึงไม่มีวิธีรักษาเนื้องอกเนื้อแข็ง และความก้าวหน้าของพวกมันสามารถควบคุมได้ด้วยวิธีการต่างๆ เท่านั้น แม้ว่าการบำบัดด้วยเซลล์ T ตัวรับแอนติเจนไคเมอริก (CAR-T) จะประสบความสำเร็จอย่างมากในเนื้องอกทางโลหิตวิทยา แต่ก็ยังไม่มีความก้าวหน้าที่ยิ่งใหญ่กว่าในการรักษาเนื้องอกเนื้อแข็ง ส่งผลให้ผู้วิจัยหันความหวังในการรักษาเนื้องอกเนื้อแข็งไปที่ TCR-T ซึ่งเป็นวิธีการทางเลือกในการบำบัดเซลล์ที่วางขายทั่วไป (ACT)
02 การบำบัดด้วย TCR-T คืออะไร
การบำบัดด้วยเซลล์ T ตัวรับแอนติเจนไคเมอริก (TCR-T) นั้นมีพื้นฐานความคิดเดียวกับ CAR-T ซึ่งเซลล์ T ที่ได้รับการออกแบบมาให้สามารถจดจำแอนติเจนได้โดยเฉพาะนั้นได้มาจากการดัดแปลงเซลล์ T ในหลอดทดลอง และเซลล์ T ที่แสดงออกในที่สุดสามารถกำหนดเป้าหมายและกำจัดเซลล์เนื้องอกเพื่อการรักษาโรคมะเร็ง [2] (รูปที่ 1)
แนวคิดการรักษา:
(1) เก็บเลือดจากผู้ป่วยให้เพียงพอเพื่อให้ได้เซลล์โมโนนิวเคลียร์รอบข้าง (PBMC)
(2) การแยกและการทำให้บริสุทธิ์ของเซลล์ T จาก PBMC
(3) การเพาะเลี้ยงในหลอดทดลองเพื่อขยายเซลล์ T
(4) การนำชิ้นส่วนยีน TCR หรือ CAR เข้าไปดัดแปลงในเซลล์ T (ผ่านเวกเตอร์ไวรัส เช่น เลนติไวรัสและเรโทรไวรัส)
(5) หลังจากขยายพันธุ์และควบคุมคุณภาพอย่างต่อเนื่องแล้ว TCR-T/CAR-T ที่ได้รับการดัดแปลงจะถูกนำกลับเข้าไปในผู้ป่วย
ซึ่งแตกต่างจากการบำบัดด้วย CAR-T ซึ่งจดจำเป้าหมายแอนติเจนพื้นผิวเซลล์เนื้องอกผ่านโครงสร้าง CAR การบำบัดด้วย TCR-T นั้นอาศัยการจับกันของตัวรับเซลล์ T (TCR) กับแอนติเจนภายในเซลล์ที่นำเสนอโดย MHC เพื่อจดจำเซลล์เนื้องอก เพื่อทำความเข้าใจกลไกของ TCR-T จำเป็นต้องเข้าใจโครงสร้างและกลไกการทำงานของคอมเพล็กซ์เมเจอร์ฮิสโตคอมแพทิบิลิตี้ (MHC) และตัวรับเซลล์ T (TCR)
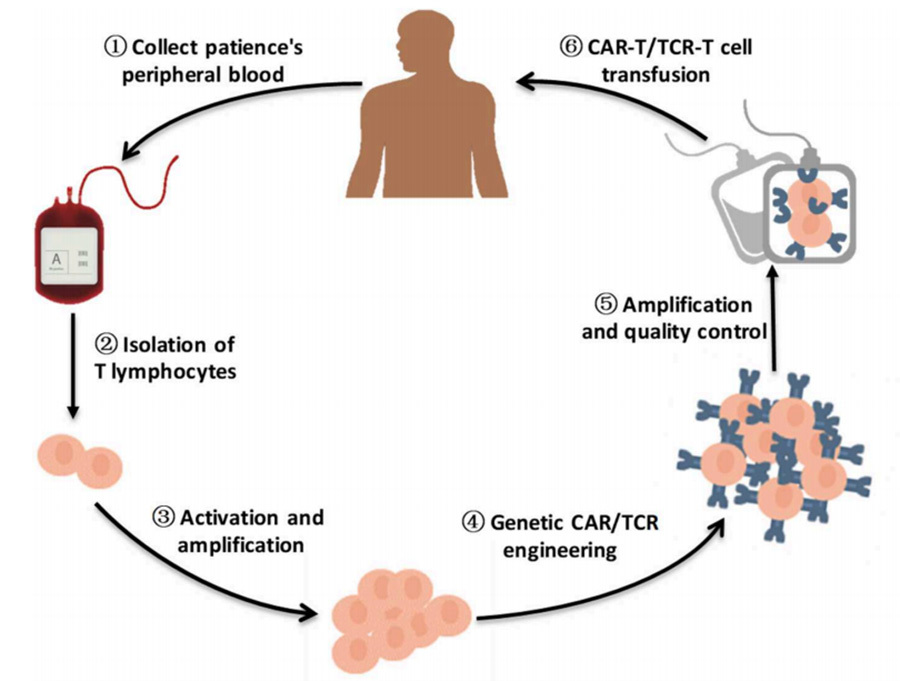
▲รูปที่ 1 แผนภูมิการไหลอย่างย่อของการบำบัดด้วยเซลล์ T ที่ได้รับการออกแบบ
03 โครงสร้างและหน้าที่ของ MHC
มี MHC สองประเภท ได้แก่ MHC-I และ MHC-II ซึ่งเข้ารหัสโดยตำแหน่งแอนติเจนของเม็ดเลือดขาว (HLA) บนแขนสั้นของโครโมโซม 6 ของมนุษย์ ซึ่งแสดงออกในระดับต่างๆ บนพื้นผิวเซลล์ ในบรรดา HLA-A, HLA-B และ HLA-C นั้นเข้ารหัสโมเลกุลประเภท I ของ MHC-I และ HLA-DR, HLA-DQ และ HLA-DP เข้ารหัสโมเลกุลประเภท II ของ MHC-II [3] (รูปที่ 2) ยีน HLA มีบทบาทสำคัญมากในระบบภูมิคุ้มกัน และระบบภูมิคุ้มกันของมนุษย์แยกแยะระหว่างเซลล์ตัวเองและเซลล์ที่ไม่ใช่ตัวเองโดยผลิตภัณฑ์ที่เข้ารหัสโดยยีน HLA ความไม่ตรงกันระหว่างยีน HLA ของผู้บริจาคอวัยวะและยีน HLA ระหว่างผู้ป่วยมักส่งผลให้เกิดการต่อต้านภูมิคุ้มกัน
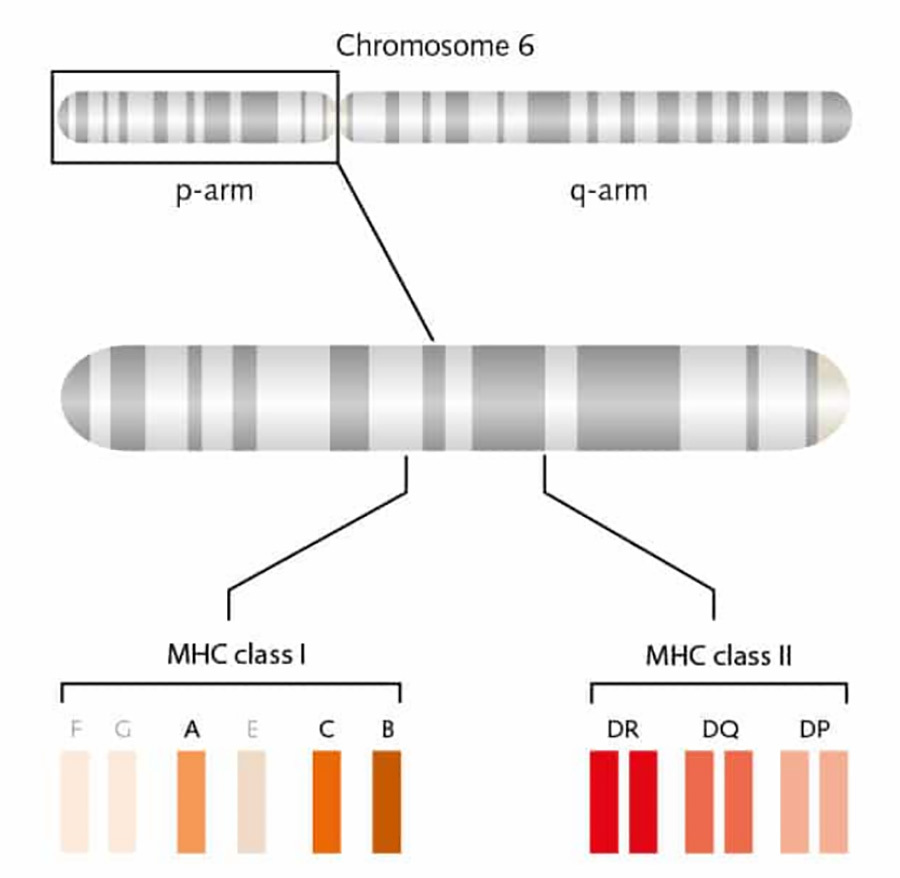
▲รูปที่ 2 การแสดงภาพแบบจำลองของตำแหน่ง HLA ของมนุษย์
MHC-I มีหน้าที่ในการนำเสนอโมเลกุลส่งสัญญาณแอนติเจนภายในเซลล์ แสดงออกบนพื้นผิวของเซลล์นิวเคลียสเกือบทั้งหมดและประกอบด้วย α-chain และ β-globin โดยที่โดเมน α1 และ α2 จะสร้างร่อง ซึ่งเป็นรอยแยกที่จับกับเปปไทด์ ซึ่งอนุญาตให้เศษเปปไทด์แอนติเจนจับและนำเสนอบนพื้นผิวของเยื่อหุ้มเซลล์ MHC-II มีหน้าที่ในการนำเสนอโมเลกุลส่งสัญญาณภายนอก และแสดงออกบนพื้นผิวของเซลล์ที่นำเสนอแอนติเจน (APC) เช่น โมโนไซต์-แมคโครฟาจ เซลล์เดนไดรติก และเซลล์ B MHC-II มีหน้าที่ในการนำเสนอโมเลกุลส่งสัญญาณภายนอกและแสดงออกบนพื้นผิวของเซลล์ที่นำเสนอแอนติเจน (APC) เช่น โมโนไซต์-แมคโครฟาจ เซลล์เดนไดรติก และเซลล์ B MHC-II ประกอบด้วยสองสาย α และ β โดยที่ร่องที่เกิดขึ้นระหว่าง α1 และ β1 เกี่ยวข้องกับการจับเศษเปปไทด์แอนติเจน [4] (รูปที่ III)
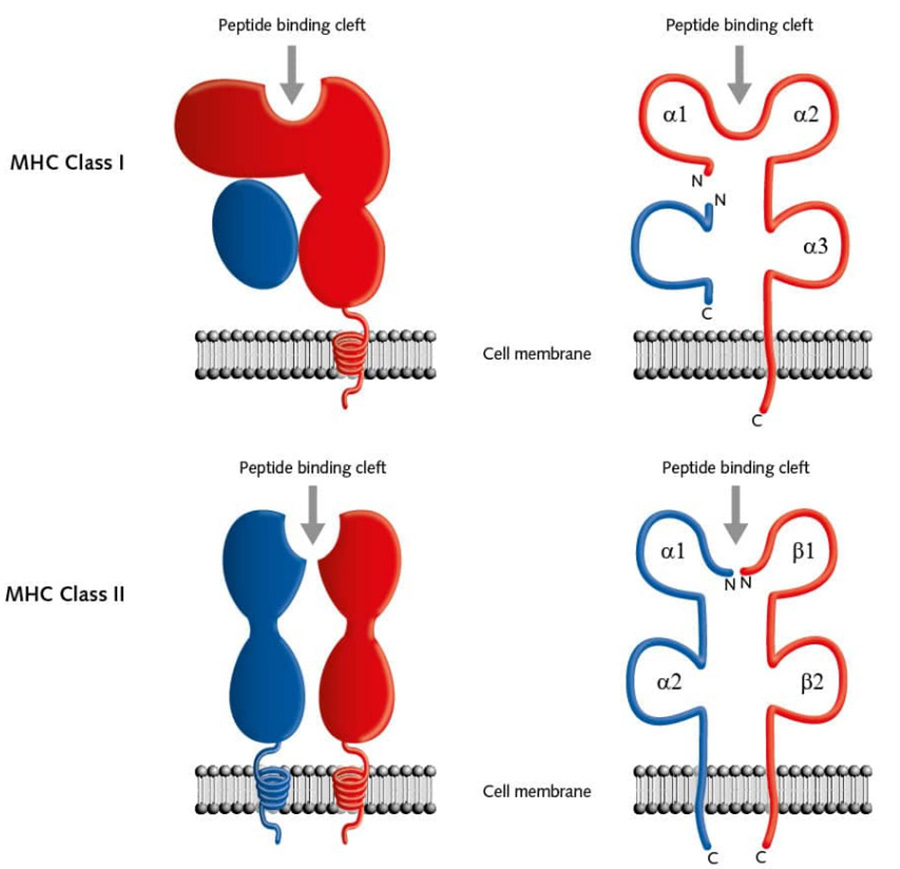
▲รูปที่ 3 โครงสร้างแผนภาพของ MHC (HLA)
แอนติเจนภายในเซลล์เป็นโปรตีนที่ผลิตโดยเซลล์เอง เช่น เปลือกโปรตีนที่สังเคราะห์โดยใช้เซลล์โฮสต์หลังจากการติดเชื้อไวรัสหรือโปรตีนเนื้องอกจากการบาดเจ็บจากมะเร็ง ภายในเซลล์ โปรตีนภายในเซลล์เหล่านี้จะสร้างเปปไทด์โมเลกุลขนาดเล็กเมื่อผ่านกระบวนการโดยเซลล์ของตัวเอง ซึ่งจากนั้นจะจับกับ MHC-I เพื่อสร้างคอมเพล็กซ์ pMHC-I และนำเสนอไปยังพื้นผิวของเยื่อหุ้มเซลล์เพื่อจับกับเซลล์ CD8+ T ซึ่งช่วยในการตายของเซลล์หรือการตายของเซลล์แบบตั้งโปรแกรม (รูปที่ 4 ด้านซ้าย)
เมื่อแอนติเจนไม่ได้สังเคราะห์โดยเซลล์จากภายใน แต่รุกรานจากภายนอก เช่น การติดเชื้อแบคทีเรียหรือเชื้อรา เซลล์ APC จะนำเข้าไปในเซลล์โดยการกินเซลล์และย่อยสลายเป็นเศษชิ้นเล็กๆ ของโมเลกุลแอนติเจนของสายเปปไทด์ โมเลกุลแอนติเจนที่ได้จะจับกับ MHC-II เพื่อสร้างคอมเพล็กซ์ pMHC-II และนำเสนอไปยังพื้นผิวของเยื่อหุ้มเซลล์ ซึ่งคอมเพล็กซ์ pMHC-II จะจับกับเซลล์ CD4+ T เพื่อสร้างคอลัมน์ของการตอบสนองภูมิคุ้มกันเพื่อกำจัดแอนติเจน (รูปที่ 4 ด้านขวา)
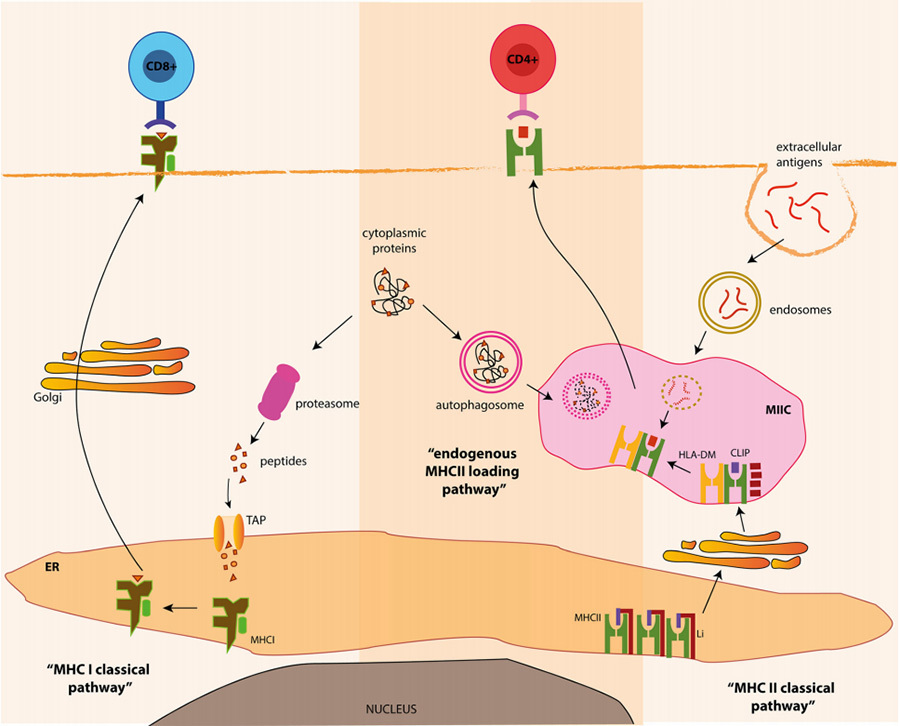
▲รูปที่ 4 แผนภาพเส้นทางคลาสสิกของ MHC [5]
04 โครงสร้างและหน้าที่ของ TCR
จากการแนะนำข้างต้น เราเข้าใจว่าการจดจำแอนติเจนของ TCR-T ขึ้นอยู่กับ MHC ในการนำเสนอโมเลกุลแอนติเจนภายในเซลล์ไปยังพื้นผิวของเยื่อหุ้มเซลล์ ดังนั้น MHC จึงเป็นส่วนประกอบที่สำคัญสำหรับการทำงานของ TCR-T คอมเพล็กซ์ TCR เป็นอีกส่วนประกอบที่สำคัญของ TCR-T เพื่อกระตุ้นการทำงานของลิมโฟไซต์ T คอมเพล็กซ์ TCR ต้องมีปฏิกิริยากับคอมเพล็กซ์ MHC ที่มีแอนติเจน (pMHC)
TCR ที่ใช้ในการออกแบบ TCR-T ทางพันธุวิศวกรรมประกอบด้วยเฮเทอโรไดเมอร์ของสาย α และ β ซึ่งเป็นโครงสร้างที่จำเป็นสำหรับ TCR ในการจับกับ pMHC แต่สิ่งนี้ไม่เพียงพอที่จะทำให้เกิดการกระตุ้นเซลล์ T การกระตุ้นเซลล์ T ขึ้นอยู่กับการส่งสัญญาณโดยโมเลกุล CD3 ซึ่งประกอบด้วยเฮเทอโรไดเมอร์สองตัว CD3ε และ CD3δ, CD3ε และ CD3γ และโฮโมไดเมอร์หนึ่งตัว CD3ζ (การกระตุ้นเซลล์ T ของ CD3 ขึ้นอยู่กับการฟอสโฟรีเลชั่นของโมทีฟการกระตุ้นกรดอะมิโนคอมเพล็กซ์ตัวรับภูมิคุ้มกัน (ITAM) ของแต่ละหน่วยย่อย (รูปที่ 5)
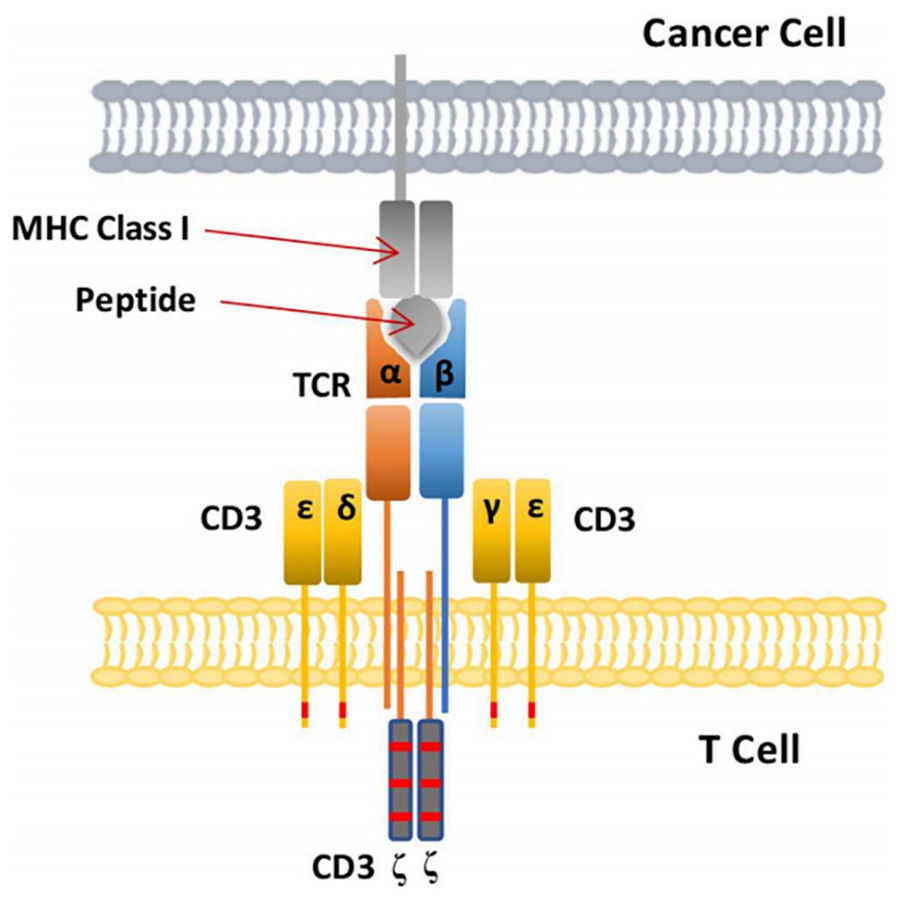
▲รูปที่ V การแสดงภาพแบบจำลองของ TCR ที่จับกับ pMHC ในเซลล์เนื้องอก [2]
05 TCRs และ CARs
TCR-T และ CAR-T ต่างก็เป็นเซลล์ T ที่ผ่านการดัดแปลงพันธุกรรมโดยมีคุณสมบัติในการระบุและกำจัดเนื้องอกได้อย่างเฉพาะเจาะจง จากนั้นจึงนำกลับเข้าสู่ร่างกายเพื่อรักษาโรคมะเร็ง แอนติเจนเป้าหมายที่ CAR-T รู้จักคือโปรตีนบนพื้นผิวเซลล์ และจำนวนโปรตีนเป้าหมายเหล่านี้มีจำกัด TCR-T สามารถจดจำเศษโปรตีนภายในเซลล์ที่ส่งโดยโมเลกุล MHC ได้ ดังนั้นช่วงของแอนติเจนเป้าหมายสำหรับ TCR-T จึงกว้างกว่ามาก แก่นแท้ของเทคโนโลยี TCR-T คือการปรับเปลี่ยนการจับกันของ TCR กับแอนติเจนเนื้องอก ซึ่ง TCR ตามธรรมชาติในร่างกายมนุษย์มี ái ความสัมพันธ์ค่อนข้างต่ำและไม่สามารถจดจำและฆ่าเซลล์เนื้องอกได้ TCR ที่ออกแบบขึ้นมาใหม่ที่มี ái สูงช่วยเพิ่มการจดจำและ ái ในการจดจำเซลล์เนื้องอก
อย่างไรก็ตาม การรักษาด้วย TCR-T นั้นจำกัดด้วยเซลล์ MHC และอาศัยการนำเสนอของโมเลกุล MHC เพื่อจดจำและกระตุ้นเซลล์ T ซึ่งเป็นข้อเสียของ TCR-T MHC ถูกเข้ารหัสโดยยีน HLA ซึ่งเป็นยีนที่มี polymorphism มากที่สุดในจีโนมของมนุษย์ และคาดว่ามี HLA I human alleles มากกว่า 20,000 alleles ที่ได้รับการระบุจนถึงปัจจุบัน ผู้ป่วยที่กำลังเข้ารับการรักษาด้วย TCR-T ต้องไม่เพียงแต่แสดงแอนติเจนเป้าหมายเท่านั้น แต่ยังต้องมีแอนติเจน HLA allele ที่ตรงกันด้วย ด้วยเหตุนี้ การรักษาด้วย TCR-T จึงมักใช้ TCR ที่จำกัดอยู่ที่ HLA alleles ที่พบได้บ่อย
06 Outlook
เมื่อวันที่ 25 มกราคม 2022 ผลิตภัณฑ์การรักษาด้วย TCR-T ตัวแรกของโลกได้รับการอนุมัติให้วางตลาดโดย FAD ซึ่งก็คือ Kimmtrak (tebentafusp-tebn, IMCgp100) ของ Immunocore สำหรับผู้ป่วยผู้ใหญ่ที่มีเนื้องอกมะเร็งตาชนิดร้ายแรงที่ไม่สามารถผ่าตัดได้หรือลุกลาม (mUM) ซึ่งเป็นบวก HLA-A*02:01 นี่เป็นความก้าวหน้าครั้งสำคัญสำหรับการรักษาด้วยเซลล์แบบ over-the-counter ในเนื้องอกที่เป็นของแข็ง บริษัทในประเทศ เช่น WuXi Juno, Fosun Kite และ Xiangxue Life Sciences ได้วางแผนการรักษาด้วย TCR-T ไว้แล้วเช่นกัน TAEST16001 เป็นผลิตภัณฑ์ที่พัฒนาโดย Xiangxue Life Sciences ซึ่งปัจจุบันอยู่ระหว่างการทดลองทางคลินิกเฟส II TCR-T ยังคงเผชิญกับความท้าทายมากมายในการรักษาโรคมะเร็ง เช่น ความจำเป็นในการระบุแอนติเจนที่เฉพาะเจาะจงกับเซลล์เนื้องอกและ TCR ที่ได้รับการยอมรับมากขึ้น และวิธีการปรับปรุงความสัมพันธ์กับแอนติเจนโดยการปรับเปลี่ยน TCR เพื่อปรับปรุงการจดจำและ ái ที่เฉพาะเจาะจงสำหรับแอนติเจน และปัญหาอื่นๆ ยังคงต้องมีการวิจัยเพิ่มเติม ไม่ว่าในกรณีใด การรักษาด้วยเซลล์แบบ overcell ที่แสดงโดย TCR-T ได้แสดงให้เห็นถึงข้อดีอย่างมากในการรักษาเนื้องอกและเป็นเทคโนโลยีสำคัญในการแก้ปัญหาโรคมะเร็ง


